สารรอบตัว
สารรอบตัว
สมบัติของสาร
สาร หมายถึง สิ่งที่มีมวล ต้องการที่อยู่และสัมผัสได้ มีทั้งสถานะที่เป็นของแข็ง ของเหลว และก๊าซ ตัวอย่างเช่น เงิน (Ag) และเกลือแกง (NaCl) เป็นของแข็ง น้ำ (H2O) และเอธานอล (C2H5O) เป็นของเหลว คาร์บอนไดออกไซด์ (CO2) และก๊าซออกซิเจน (O2) เป็นก๊าซ เป็นต้น

ภาพสาร
สมบัติของสาร หมายถึง ลักษณะประจำตัวของสาร เช่น สถานะ สี กลิ่น รส การละลาย การนำไฟฟ้า จุดเดือด และการเผาไหม้ เป็นต้น
สมบัติของสาร อาจจะนำมาแบ่งเป็น 2 ประเภท ดังนี้
ก. สมบัติทางกายภาพ หมายถึง สมบัติเฉพาะตัวของสารที่สามารถสังเกตเห็นได้ง่ายจากลักษณะภายนอก หรือจากการทดลองง่ายๆ โดยไม่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมี ตัวอย่างทางกายภาพได้แก่ สถานะ รูปร่าง สี กลิ่น รส การละลาย จุดเดือด จุดหลอมเหลว ความหนาแน่น การนำความร้อน การนำไฟฟ้า ความร้อนแฝง ความถ่วงจำเพาะ เป็นต้น
ข. สมบัติทางเคมี หมายถึง สมบัติเฉพาะตัวของสารที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมี เช่น การเกิดสารใหม่ การสลายตัวให้ได้สารใหม่ การเผาไหม้ การระเบิด และการเกิดสนิมของโลหะ เป็นต้น
การจำแนกสาร
การจัดจำพวกสารโดยใช้เนื้อสารเป็นเกณฑ์ สามารถแยกได้ 2 ชนิด คือ
สารเนื้อเดียว (Homogeneous Substance) หมายถึง สารที่มีลักษณะเนื้อของสารและสมบัติเหมือนกันตลอดทั้งมวลของสารนั้น ได้แก่ ธาตุ สารประกอบ และสารละลาย เช่น น้ำเกลือ น้ำกลั่น ทองแดง เป็นต้น
สารเนื้อเดียวที่มีองค์ประกอบทางกายภาพเพียงอย่างเดียว ไม่สามารถแยกองค์ประกอบด้วยวิธีทางกายภาพได้อีก เรียกว่า สารบริสุทธิ์ (Pure Substance ) ส่วนสารเนื้อเดียวที่มีองค์ประกอบมากกว่า 1 อย่างและสามารถแยกองค์ประกอบออกจากกันด้วยวิธีทางกายภาพ เรียกว่า ของผสมเนื้อเดียว หรือสารละลาย (Solution)
สารเนื้อผสม (Heterogeneous Substance) หมายถึง สารที่มีลักษณะเนื้อของสารและสมบัติไม่เหมือนกันตลอดทั้งมวลของสารนั้น สามารถมองเห็นองค์ประกอบที่แตกต่างกันได้แก่ สารแขวนลอย เช่น น้ำโคลน ส้มต้ม ลอดช่องในน้ำกะทิ เป็นต้น
สารบริสุทธิ์ หมายถึง สารที่ประกอบด้วยสารเพียงชนิดเดียว อาจเป็นของแข็ง ของเหลวหรือก๊าซก็ได้ อาจเป็นธาตุหรือสารประกอบก็ได้ ตัวอย่างเช่น เหล็ก ทองแดง น้ำ น้ำตาล ออกซิเจน คาร์บอนไดออกไซด์ เป็นสารบริสุทธิ์ แต่น้ำเชื่อม พริกกับเกลือ ไม่ใช่สารบริสุทธิ์
ธาตุ (Element) หมายถึง สารบริสุทธิ์ที่มีองค์ประกอบอย่างเดียว ธาตุไม่สามารถจะนำมาแยกสลายให้กลายเป็นสารอื่นโดยวิธีการทางเคมี ธาตุมีทั้งสถานะที่เป็นของแข็ง เช่น ธาตุสังกะสี(Zn) ตะกั่ว(Pb) เงิน (Ag) และดีบุก (Sn) , เป็นของเหลว เช่น ปรอท (Hg) เป็นก๊าซ เช่น ไนโตรเจน (N2) ฮีเลียม (He) ออกซิเจน (O2) ไฮโดรเจน (H2) เป็นต้น
ธาตุโลหะ (metal) จะเป็นธาตุที่มีสถานะเป็นของแข็ง (ยกเว้นปรอท ที่เป็นของเหลว ) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง (ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na), เหล็ก (Fe) , แคลเซียม (Ca) , ปรอท (Hg), อะลูมิเนียม (Al), แมกนีเซียม (Mg) , สังกะสี (Zn) , ดีบุก (Sn) ฯลฯ
ธาตุอโลหะ มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) , ฟอสฟอรัส (P) ,กำมะถัน (S) โบรมีน (Br), ออกซิเจน (O2) ไฮโดรเจน (H2), คลอรีน (Cl2) , ฟลูออรีน (F2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) ได้แก่ โบรอน (B) , ซิลิคอน ( Si) , เป็นต้น
หมายเหตุ
ก. ธาตุกึ่งโลหะ ถ้าใช้การนำไฟฟ้าเป็นเกณฑ์ จะหมายถึง ธาตุที่นำไฟฟ้าได้เล็กน้อยที่อุณหภูมิปกติ แต่ที่อุณหภูมิสูงขึ้นจะนำไฟฟ้าได้มากขึ้น เช่น ธาตุโบรอน , ซิลิคอน ,เจอร์มาเนียม , อาร์เซนิก
ก. ธาตุกึ่งโลหะ ถ้าใช้การนำไฟฟ้าเป็นเกณฑ์ จะหมายถึง ธาตุที่นำไฟฟ้าได้เล็กน้อยที่อุณหภูมิปกติ แต่ที่อุณหภูมิสูงขึ้นจะนำไฟฟ้าได้มากขึ้น เช่น ธาตุโบรอน , ซิลิคอน ,เจอร์มาเนียม , อาร์เซนิก
ข. ธาตุกึ่งโลหะ ถ้าใช้สมบัติของออกไซด์เป็นเกณฑ์ จะหมายถึง ธาตุที่เกิดเป็นออกไซด์แล้วทำปฏิกิริยาได้ทั้งกรดแก่และเบสแก่ เช่น ธาตุเบริลเลียม , อะลูมิเนียม , แกลเลียม , ดีบุก , และตะกั่ว
สารประกอบ (compound) หมายถึง “สารบริสุทธิ์เนื้อเดียวที่เกิดจากธาตุตั้งแต่สองชนิดขึ้นไปเป็นองค์ประกอบ” สารประกอบเกิดจากการรวมตัวของธาตุโดยวิธีการทางเคมี สามารถแยกสลายให้เกิดเป็นสารใหม่หรือกลับคืนเป็นธาตุเดิมได้ สารประกอบจะมีสมบัติเฉพาะตัวที่แตกต่างจากธาตุเดิม เช่น น้ำ มีสูตรเคมีเป็น H2O น้ำเป็นสารประกอบที่เกิดจากธาตุไฮโดรเจน(H) และออกซิเจน(O) แต่มีสมบัติแตกต่างจากไฮโดรเจน และออกซิเจน น้ำตาลทรายประกอบด้วยธาตุคาร์บอน (C),ไฮโดรเจน (H) ,และออกซิเจน (O) เป็นต้น
กัมมันตรังสี (radioactivity) หมายถึง ปรากฏการณ์ที่ธาตุสามารถแผ่รังสีได้เองอย่างต่อเนื่อง ปรากฏการณ์นี้เป็นการเปลี่ยนแปลงที่เกิดขึ้นภายในนิวเคลียสของไอโซโทปที่ไม่เสถียร
ธาตุกัมมันตรังสี หมายถึง ธาตุที่มีสมบัติในการแผ่รังสี สามารถแผ่รังสีและกลายเป็นอะตอมของธาตุอื่นได้
รังสีที่เปล่งออกมาจะมีอยู่ 3 ชนิด ดังนี้
รังสีแอลฟา มีสัญลักษณ์นิวเคลียร์เป็น 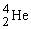 บางครั้งอาจเรียกว่า อนุภาคแอลฟา และใช้สัญลักษณ์เป็น
บางครั้งอาจเรียกว่า อนุภาคแอลฟา และใช้สัญลักษณ์เป็น 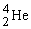
รังสีแอลฟาเป็นนิวเคลียสของธาตุฮีเลียม ซึ่งประกอบด้วย 2 โปรตอน และ 2 นิวตรอนจึงมีประจุไฟฟ้าเป็น +2 มีมวล 4.00276 amu รังสีแอลฟาอำนาจทะลุทะลวงต่ำ ไม่สามารถทะลุผ่านแผ่นกระดาษ หรือโลหะบางๆ ได้ และเนื่องจากมีประจุบวก เมื่ออยู่ในสนามไฟฟ้าจึงเบี่ยงเบนไปทางขั้วลบ เมื่อวิ่งผ่านอากาศอาจจะทำให้อากาศแตกตัวเป็นไอออนได้
รังสีบีตา บางครั้งเรียกว่าอนุภาคบีตา ใช้สัญลักษณ์เป็น b หรือ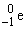 รังสีบีตา มีสมบัติเหมือนอิเล็กตรอน คือ มีประจุไฟฟ้า -1 มีมวลเท่ากับ 0.000540 amu เท่ากับมวลของอิเล็กตรอน รังสีบีตามีอำนาจในการทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า มีความเร็วในการเคลื่อนที่ใกล้เคียงกับแสง เนื่องจากมีประจุลบจึงเบี่ยงเบนไปทางขั้วบวก เมื่ออยู่ในสนามไฟฟ้า
รังสีบีตา มีสมบัติเหมือนอิเล็กตรอน คือ มีประจุไฟฟ้า -1 มีมวลเท่ากับ 0.000540 amu เท่ากับมวลของอิเล็กตรอน รังสีบีตามีอำนาจในการทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า มีความเร็วในการเคลื่อนที่ใกล้เคียงกับแสง เนื่องจากมีประจุลบจึงเบี่ยงเบนไปทางขั้วบวก เมื่ออยู่ในสนามไฟฟ้า
รังสีแกมมา ใช้สัญลักษณ์
รังสีแอลฟาเป็นนิวเคลียสของธาตุฮีเลียม ซึ่งประกอบด้วย 2 โปรตอน และ 2 นิวตรอนจึงมีประจุไฟฟ้าเป็น +2 มีมวล 4.00276 amu รังสีแอลฟาอำนาจทะลุทะลวงต่ำ ไม่สามารถทะลุผ่านแผ่นกระดาษ หรือโลหะบางๆ ได้ และเนื่องจากมีประจุบวก เมื่ออยู่ในสนามไฟฟ้าจึงเบี่ยงเบนไปทางขั้วลบ เมื่อวิ่งผ่านอากาศอาจจะทำให้อากาศแตกตัวเป็นไอออนได้
รังสีบีตา บางครั้งเรียกว่าอนุภาคบีตา ใช้สัญลักษณ์เป็น b หรือ
รังสีแกมมา ใช้สัญลักษณ์
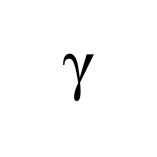
รังสีแกมมาเป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก คือประมาณ 0.001-1.5 pm ไม่มีมวลและไม่มีประจุ มีอำนาจทะลุทะลวงสูงสุด สามารถทะลุผ่านสิ่งกีดขวางได้เป็นอย่างดี ดังนั้นวัตถุที่จะกั้นรังสีแกมมาได้ จะต้องมีความหนาแน่นและความหนามากพอที่จะกั้นรังสีได้ เนื่องจากไม่มีประจุไฟฟ้า จึงไม่เบี่ยงเบนในสนามไฟฟ้า
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
- ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
- ปฏิกิริยาฟิวชัน (Fusion reaction) คือ ปฏิกิริยานิวเคลียร์ที่นิวเคลียสของธาตุเบาหลอมรวมกันเข้าเป็นนิวเคลียสที่หนักกว่า และมีการคายความร้อนออกมาจำนวนมหาศาลและมากกว่าปฏิกิริยาฟิชชันเสียอีก ปฏิกิริยาฟิวชันที่รู้จักกันดี คือ ปฏิกิริยาระเบิดไฮโดรเจน (Hydrogen bomb)
ประโยชน์จากการใช้ธาตุกัมมันตรังสี ด้านธรณีวิทยา การใช้คาร์บอน-14 (C-14) คำนวณหาอายุของวัตถุโบราณ
ด้านการแพทย์ ใช้ไอโอดีน-131 (I-131) ในการติดตามเพื่อศึกษาความผิดปกติของต่อมไธรอยด์ โคบอลต์-60 (Co-60) และเรเดียม-226 (Ra-226) ใช้รักษาโรคมะเร็ง ด้านเกษตรกรรมใช้ฟอสฟอรัส 32 (P-32) ศึกษาความต้องการปุ๋ยของพืช ปรับปรุงเมล็ดพันธุ์ที่ต้องการ และใช้โพแทสเซียม-32 (K–32) ในการหาอัตราการดูดซึมของต้นไม้
ด้านอุตสาหกรรม ใช้ธาตุกัมมันตรังสีตรวจหารอยตำหนิ เช่น รอยร้าวของโลหะหรือท่อขนส่งของเหลว ใช้ธาตุกัมมันตรังสีในการ ตรวจสอบและควบคุมความหนาของวัตถุ ใช้รังสีฉายบนอัญมณีเพื่อให้มีสีสันสวยงาม
ด้านการถนอมอาหาร ใช้รังสีแกมมาของธาตุโคบอลต์-60 (Co–60) ปริมาณที่พอเหมาะใช้ทำลายแบคทีเรียในอาหาร จึงช่วยให้เก็บรักษาอาหารไว้ได้นานขึ้น
ด้านพลังงาน มีการใช้พลังงานความร้อนที่ได้จากปฏิกิริยานิวเคลียร์ในเตาปฏิกรณ์ปรมาณูของ ยูเรเนียม-238 (U-238) ต้มน้ำให้กลายเป็นไอ แล้วผ่านไอน้ำไปหมุนกังหัน เพื่อผลิตกระแสไฟฟ้า
ด้านการแพทย์ ใช้ไอโอดีน-131 (I-131) ในการติดตามเพื่อศึกษาความผิดปกติของต่อมไธรอยด์ โคบอลต์-60 (Co-60) และเรเดียม-226 (Ra-226) ใช้รักษาโรคมะเร็ง ด้านเกษตรกรรมใช้ฟอสฟอรัส 32 (P-32) ศึกษาความต้องการปุ๋ยของพืช ปรับปรุงเมล็ดพันธุ์ที่ต้องการ และใช้โพแทสเซียม-32 (K–32) ในการหาอัตราการดูดซึมของต้นไม้
ด้านอุตสาหกรรม ใช้ธาตุกัมมันตรังสีตรวจหารอยตำหนิ เช่น รอยร้าวของโลหะหรือท่อขนส่งของเหลว ใช้ธาตุกัมมันตรังสีในการ ตรวจสอบและควบคุมความหนาของวัตถุ ใช้รังสีฉายบนอัญมณีเพื่อให้มีสีสันสวยงาม
ด้านการถนอมอาหาร ใช้รังสีแกมมาของธาตุโคบอลต์-60 (Co–60) ปริมาณที่พอเหมาะใช้ทำลายแบคทีเรียในอาหาร จึงช่วยให้เก็บรักษาอาหารไว้ได้นานขึ้น
ด้านพลังงาน มีการใช้พลังงานความร้อนที่ได้จากปฏิกิริยานิวเคลียร์ในเตาปฏิกรณ์ปรมาณูของ ยูเรเนียม-238 (U-238) ต้มน้ำให้กลายเป็นไอ แล้วผ่านไอน้ำไปหมุนกังหัน เพื่อผลิตกระแสไฟฟ้า
โทษของธาตุกัมมันตรังสี 1. ถ้าร่างกายได้รับจะทำให้โมเลกุลภายในเซลล์เกิดการเปลี่ยนแปลงไม่สามารถทำงานตามปกติได้ ถ้าเป็นเซลล์ที่เกี่ยวข้องกับการถ่ายทอดลักษณะพันธุกรรมก็จะเกิดการผ่าเหล่า โดยเฉพาะเซลล์สืบพันธุ์เมื่อเข้าไปในร่างกายจะไปสะสมในกระดูก
2. ส่วนผลที่ทำให้เกิดความป่วยไข้จากรังสี เมื่ออวัยวะส่วนใดส่วนหนึ่งของร่างกายได้รับรังสี โมเลกุลของธาตุต่างๆ ที่ประกอบเป็นเซลล์จะแตกตัว ทำให้เกิดอาการป่วยไข้และเกิดมะเร็งได้
2. ส่วนผลที่ทำให้เกิดความป่วยไข้จากรังสี เมื่ออวัยวะส่วนใดส่วนหนึ่งของร่างกายได้รับรังสี โมเลกุลของธาตุต่างๆ ที่ประกอบเป็นเซลล์จะแตกตัว ทำให้เกิดอาการป่วยไข้และเกิดมะเร็งได้
ความคิดเห็น
แสดงความคิดเห็น