การละลาย
การละลาย
(Solubility)
ความหมายของการละลาย
การละลาย (Dissolve) คือ การที่สารชนิดหนึ่ง (ตัวถูกละลาย) แตกตัวออกเป็นอนุภาคเล็ก ๆ และแทรกตัวในสารอีกชนิดหนึ่ง (ตัวทำละลาย) โดยทั่วไปเราพิจารณาว่า
- สารที่มีปริมาณมากกว่าเป็น ตัวทำละลาย (Solvent)
- สารที่มีปริมาณน้อยกว่าเป็น ตัวถูกละลาย (Solute)
- สารละลายที่มีน้ำเป็นตัวทำละลายเรียกว่า aqueous solution (aq)
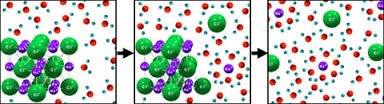
การที่อนุภาคของตัวถูกละลายจะเข้าไปแทรกตัวอยู่ระหว่างอนุภาคของตัวทำละลายได้หรือไม่ จะขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลของตัวทำละลายกับตัวทำละลาย แรงดึงดูดโมเลกุลระหว่างตัวทำละลายกับตัวถูกละลาย และแรงดึงดูดระหว่างโมเลกุลตัวถูกละลายกับตัวถูกละลาย
ปกติแล้ว การที่ตัวถูกละลายจะละลายในตัวทำละลายหนึ่ง ๆ ได้นั้น สารทั้งสองชนิดจะต้องมีสมบัติเหมือนกัน
ตามกฎ like dissolves like ก็คือ ตัวถูกละลายที่มีขั้วจะละลายในตัวทำละลายที่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลมีขั้วเป็นแรงไดโพล-ไดโพล (dipole - dipole) แต่จะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว เช่น เอทานอล (CH3CH2OH) ละลายในน้ำ (H2O) แต่ไม่ละลายในเฮกเซน (C6H14)
ในทางตรงข้าม ตัวถูกละลายที่ไม่มีขั้วจะละลายในตัวทำละลายที่ไม่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลไม่มีขั้ว เป็นแรงแวนเดอร์วาลล์ (Van der Waals force) เหมือนกัน แต่จะไม่ละลายในตัวทำละลายที่มีขั้ว เช่น คาร์บอนเตตระคลอไรด์ (CCl4) ละลายในเบนซีน (C6H6) ไม่ละลายในน้ำ แต่ถ้าในกรณีที่สารหนึ่งมีขั้วน้อยกว่าอีกสารตัวหนึ่ง ความสามารถในการละลายก็ลดลง หรืออาจจะกล่าวอีกนัยคือละลายได้เพียงบางส่วนเท่านั้น
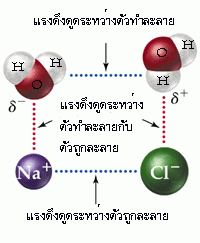
จากที่กล่าวมาจะเป็นการละลายของของเหลวในของเหลวด้วยกัน ในกรณีที่เป็นการละลายของของแข็งในของเหลวก็สามารถอธิบายโดยใช้แรงดึงดูดระหว่างโมเลกุลเช่นเดียวกัน ถ้าตัวถูกละลายเป็นสารประกอบไอออนิก ซึ่งมีแรงดึงดูดระหว่างไอออนสูงมาก ก็จะละลายในตัวทำละลายที่มีขั้วแรงได้ดีกว่าตัวทำละลายที่มีขั้วน้อยกว่า เพราะฉะนั้น สารประกอบไอออนิกจึงละลายได้ดีในตัวทำละลายที่มีขั้วแรงมากๆ เช่น เกลือ (โซเดียมคลอไรด์ : NaCl) ละลายได้ดีในน้ำ มากกว่าในตัวทำละลายที่เป็นสารประกอบพวกไฮโดรคาร์บอน (hydrocarbon compounds)
การละลายจะเป็นประเภทใดขึ้นอยู่กับชนิดของสารและตัวทำละลายที่เกี่ยวข้อง ในขณะที่สารเกิดการละลาย ตัวละลายที่เป็นของแข็งจะแยกตัวเป็นอนุภาคเล็กๆ และยึดเหนี่ยวกับโมเลกุลของตัวละลาย กระบวนการนี้เกี่ยวข้องกับพลังงาน ถ้าพลังงานที่ใช้แยกอนุภาคของของแข็งมีปริมาณน้อยกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะปล่อยพลังงานออกมา สารละลายจะมีอุณหภูมิสูงขึ้น การละลายประเภทนี้เรียกว่า การละลายประเภทคายความร้อน
ในทางกลับกัน ถ้าพลังงานที่ใช้ในการแยกอนุภาคของตัวละลายที่เป็นของแข็งมีปริมาณมากกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะดูดพลังงาน สารละลายจะมีอุณหภูมิต่ำลง การละลายประเภทนี้เรียกว่า การละลายประเภทดูดความร้อน การละลายของของเหลวหรือแก๊สในตัวทำละลายชนิดต่างๆ เกิดขึ้นได้ในทำนองเดียวกัน การละลายของสารแต่ละชนิดจะเป็นการละลายของสารประเภทดูดหรือคายความร้อนเป็นสมบัติเฉพาะตัวของสาร
ความคิดเห็น
แสดงความคิดเห็น