การไทเทรต
การไทเทรต
การไทเทรต คืออะไร
การไทเทรต (titration) เป็นการวิเคราะห์หาปริมาณของสารที่ไม่ทราบความเข้มข้น (unknown) ด้วยการวัดปริมาตรของสารละลาย ซึ่งปริมาตรของสารละลายจะมีความสัมพันธ์กับปริมาณสาร โดยทำปฏิกิริยากับสารที่ทราบปริมาณหรือความเข้มข้นที่แน่นอน โดย
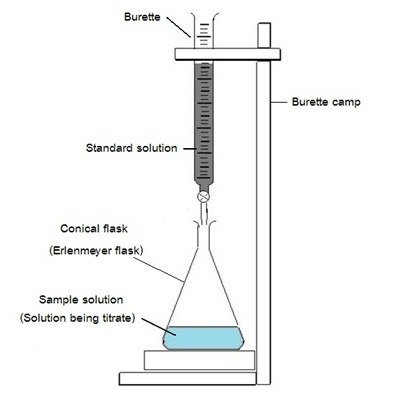
- สารที่ไม่ทราบความเข้มข้นจะบรรจุในขวดรูปชมพู่เรียกว่าไทแทรนด์ (titrand)
- สมมุติให้เป็นสาร A ส่วนสารที่ทราบความเข้มข้นแล้วหรือเรียกว่าสารมาตรฐานจะถูกบรรจุในบิวเรตต์ เรียกว่าไทแทรนต์ (titrant)
สำหรับการไทเทรตทุกชนิด จุดที่สารที่เรานำมาไทเทรตทำปฏิกิริยากันพอดี เราเรียกว่าจุดสมมูลหรือจุดสะเทิน (Equivalence Point)จุดที่กรดทำปฏิกิริยากันพอดีหรือสะเทินพอดีกับเบส ส่วนจุดที่อินดิเคเตอร์(Indicator) เปลี่ยนสี เราเรียกว่าจุดยุติ(End Point) ซึ่งเป็นจุดที่เราจะยุติการไทเทรต โดยถ้าเราใช้อินดิเคเตอร์ที่เหมาะสมจะทำให้จุดยุติตรงกับจุดสมมูลหรือใกล้เคียงกับจุดสมมูลมาก แต่ถ้าเราใช้อินดิเคเตอร์ไม่เหมาะสมอาจจะทำให้จุดยุติอยู่ห่างจากจุดสมมูลมาก ทำให้ผลการทดลองคลาดเคลื่อนได้
สมมุติให้เป็นสาร B โดยมีวัสดุอุปกรณ์ที่เกี่ยวข้อง และพบได้ทั่วไปในห้องปฏิบัติการ (ดังภาพ) ประกอบด้วย ขาตั้งเหล็ก (stand) ที่ยึดบิวเรตต์ (buret clamp) บิวเรตต์ (burette) ขวดรูปชมพู่ (erlenmeyer flask) และกระเบื้องสีขาว (tile)
ขั้นตอนของการไทเทรต
1. บรรจุสารละลายมาตรฐานลงในบิวเร็ต ไล่ฟองอากาศบริเวณส่วนปลายด้านล่างออกให้หมด
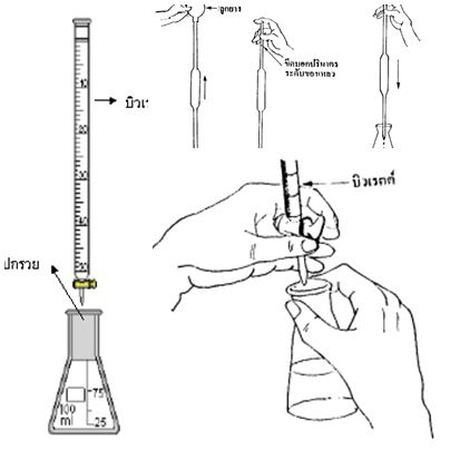
2. ใช้ปีเปตดูดสารละลายตัวอย่างแล้วใส่ลงในขวดรูปชมพู่ (จดปริมาตรของสารละลายตัวอย่างเอาไว้ด้วย)
3. หยดอินดิเคเตอร์ 2-3 หยด ลงในสารละลายตัวอย่าง
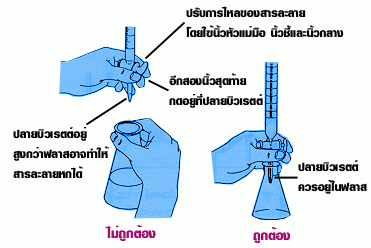
4. เปิดก๊อกที่บิวเร็ตเพื่อปล่อยให้สารละลายมาตรฐานหยดลงไปทำปฏิกิริยากับสารละลายตัวอย่าง (มีวิธีจับก๊อกที่บิวเร็ตต้องฝึกจับให้ถูกต้อง) แนะนำให้ใช้มือข้างที่ถนัดจับขวดรูปชมพู่เพราะต้องเขย่าอยู่ตลอดเวลา มือที่ไม่ถนัดใช้จับเพื่อเปิด-ปิดก๊อกที่บิวเร็ต ขั้นตอนนี้สำคัญมากควรวางกระดาษขาวเอาไว้บนโต๊ะด้วย เพื่อช่วยให้สังเกตการเปลี่ยนสีของอินดิเคเตอร์ได้ง่ายขึ้น การเปลี่ยนสีในตอนแรกจะไม่ถาวร คือเมื่อเปลี่ยนสีไปแล้วชั่วครู่ก็กลับไปเป็นอย่างเดิมอีกแสดงว่ายังไม่ถึงจุดยุติแต่ก็ใกล้มากแล้ว เมื่อถึงขั้นตอนนี้ต้องระวังมากยึ่งขึ้นในการเปิดก๊อกให้สารละลายมาตรฐานหยดลงมา ถ้ามากไปจะเลยจุดยุติได้ง่าย ผลการไทเทรตจะให้ไม่ได้ต้องเสียเวลาเริ่มต้นใหม่การสังเกตสีของอินดิเคเตอร์สำหรับบอกจุดยุติ ให้ดูที่สีอ่อน ๆ จาง ๆ ไม่ให้เข้มมาก
5. ควรไทเทรตรซ้ำอย่างน้อย 3 ครั้ง แล้วนำค่าเฉลี่ยมาคำนวณหาปริมาณสารตัวอย่าง การใช้ค่าเฉลี่ยจะช่วยให้ความคลาดเคลื่อนน้อยลง
2. ใช้ปีเปตดูดสารละลายตัวอย่างแล้วใส่ลงในขวดรูปชมพู่ (จดปริมาตรของสารละลายตัวอย่างเอาไว้ด้วย)
3. หยดอินดิเคเตอร์ 2-3 หยด ลงในสารละลายตัวอย่าง
4. เปิดก๊อกที่บิวเร็ตเพื่อปล่อยให้สารละลายมาตรฐานหยดลงไปทำปฏิกิริยากับสารละลายตัวอย่าง (มีวิธีจับก๊อกที่บิวเร็ตต้องฝึกจับให้ถูกต้อง) แนะนำให้ใช้มือข้างที่ถนัดจับขวดรูปชมพู่เพราะต้องเขย่าอยู่ตลอดเวลา มือที่ไม่ถนัดใช้จับเพื่อเปิด-ปิดก๊อกที่บิวเร็ต ขั้นตอนนี้สำคัญมากควรวางกระดาษขาวเอาไว้บนโต๊ะด้วย เพื่อช่วยให้สังเกตการเปลี่ยนสีของอินดิเคเตอร์ได้ง่ายขึ้น การเปลี่ยนสีในตอนแรกจะไม่ถาวร คือเมื่อเปลี่ยนสีไปแล้วชั่วครู่ก็กลับไปเป็นอย่างเดิมอีกแสดงว่ายังไม่ถึงจุดยุติแต่ก็ใกล้มากแล้ว เมื่อถึงขั้นตอนนี้ต้องระวังมากยึ่งขึ้นในการเปิดก๊อกให้สารละลายมาตรฐานหยดลงมา ถ้ามากไปจะเลยจุดยุติได้ง่าย ผลการไทเทรตจะให้ไม่ได้ต้องเสียเวลาเริ่มต้นใหม่การสังเกตสีของอินดิเคเตอร์สำหรับบอกจุดยุติ ให้ดูที่สีอ่อน ๆ จาง ๆ ไม่ให้เข้มมาก
5. ควรไทเทรตรซ้ำอย่างน้อย 3 ครั้ง แล้วนำค่าเฉลี่ยมาคำนวณหาปริมาณสารตัวอย่าง การใช้ค่าเฉลี่ยจะช่วยให้ความคลาดเคลื่อนน้อยลง

สามารถคำนวณหาความเข้มข้นของ สาร A ได้โดยใช้ความสัมพันธ์
จำนวนโมลของสาร A = จำนวนโมลของสาร B
Ca X Va = Cb X Vb
เมื่อ Ca = ความเข้มข้นของสาร A (unkonwn or analyst)
Cb = ความเข้มข้นของสาร B (สารมาตรฐาน)
Vb= ปริมาตรของสารB ได้จากการไทเทรต อ่านค่าจากบิวเรตต์เมื่อถึงจุดสมมูล
Va = ปริมาตรของสารA ทราบได้เพราะว่าเราปิเปตต์สาร unknown ด้วยปริมาตรที่แน่นนอนใส่ลงในขวดรูปชมพู่
ทำให้คำนวณหาค่า ความเข้มข้นของสาร A (Ca) ได้ เพราะว่าทราบค่าต่างๆ ทุกค่าแล้ว
ความคิดเห็น
แสดงความคิดเห็น